
Physiology

脂膜:物质屏障、提供稳定和必需的细胞内环境。信息的边界,保证细胞选择性、特异性地作出反应。
膜蛋白:转运蛋白作为跨膜物质转运的选择性和特异性媒介。跨膜信号的传递。
wsq:水不能过细胞膜。| 人工脂膜证明水可以单纯扩散。
Fick‘s first law:
易化扩散的Michaelis-Menton equation:
GLUT1广布、GLUT2在肝、GLUT4在肌肉与脂肪(insulin sensitive)、GLUT5在小肠上皮细胞。
AQP磷酸化可以增强活性。ADH增加肾远曲小管和集合管的AQP转移至质膜。AQP 4个单体各6次跨膜,核心氨基酸是Gln-Pro-Ala。
质膜钙泵1
稀溶液的
Nernst formula:
当
在钠钾两种离子的状态下,不考虑钠钾泵生电作用,静息时有:
进而推导出弦电导方程:

离子通道的随机活动:其开放概率可以改变——异丙肾上腺素提高电压门控钙离子通道的
离子通道的静息状态(resting/available):既不是激活也不是失活,就是
平衡电位是某一离子跨膜静电流为0时的膜电位、逆转电位是通过某一通道的静电流为0时的膜电位。
钠钾泵,一般细胞中消耗
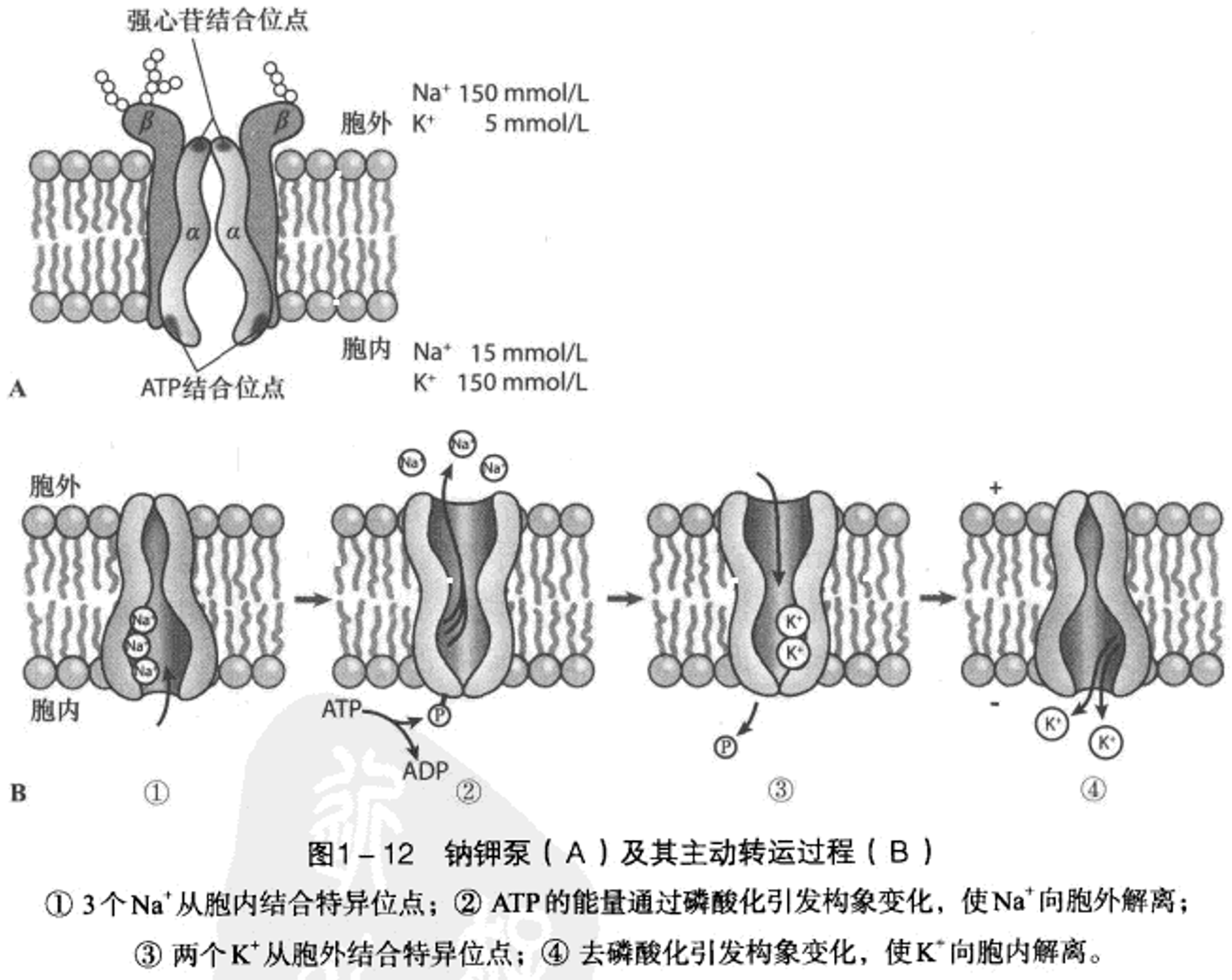
3钠1钙交换体,对钙亲和力不算高但转运速度快。胞内
Hodgkin Cycle即去极化过程中的正反馈过程。
非可兴奋细胞的被动电反应:
细胞膜处理为电容,一般细胞膜电容(
下图中
电压钳实验:先将膜电位去极化到不同的保持电位
,保持一段时间使失活过程达到稳定状态,然后阶跃到一个固定的检验电位,通过检验电位状态下的电流来反映活性通道的数量(需要与最大电流 比较进行归一化处理)

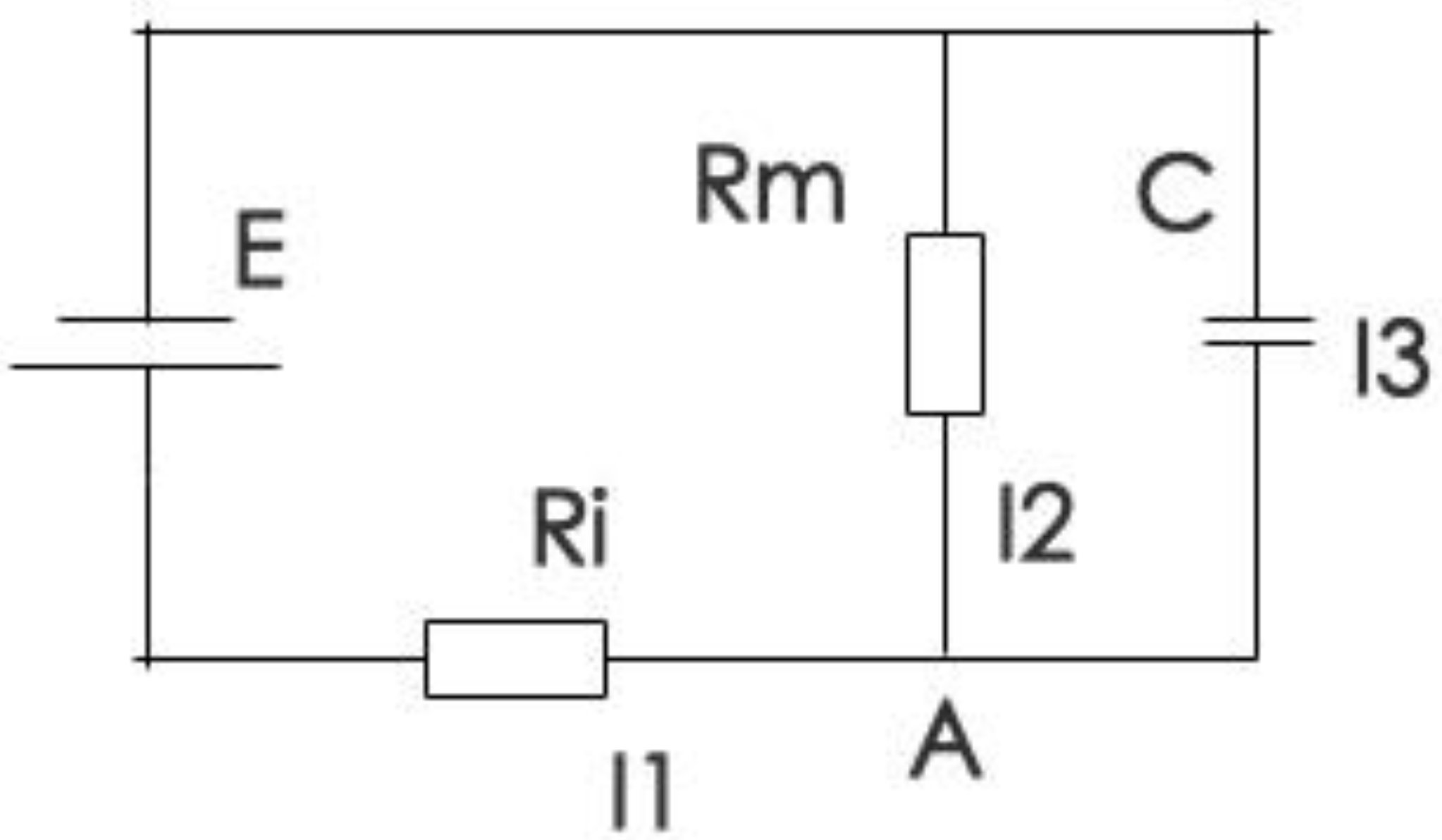
电紧张电位时间形式的推导
电紧张状态下,细胞膜上的被动电学信号的产生原理可以从一个简化产生的RC阻容电路来得到解释:
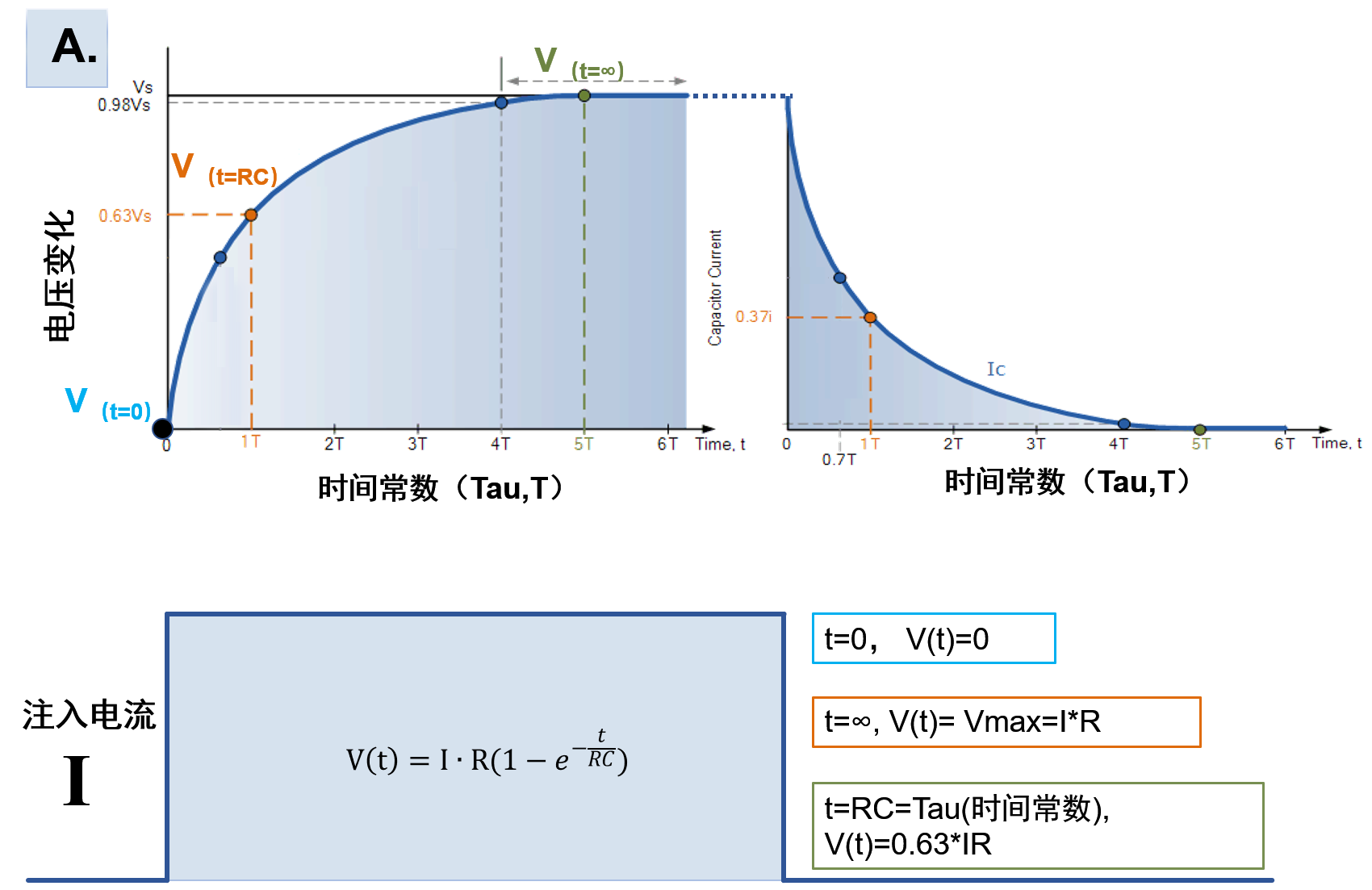
若注入的电流在
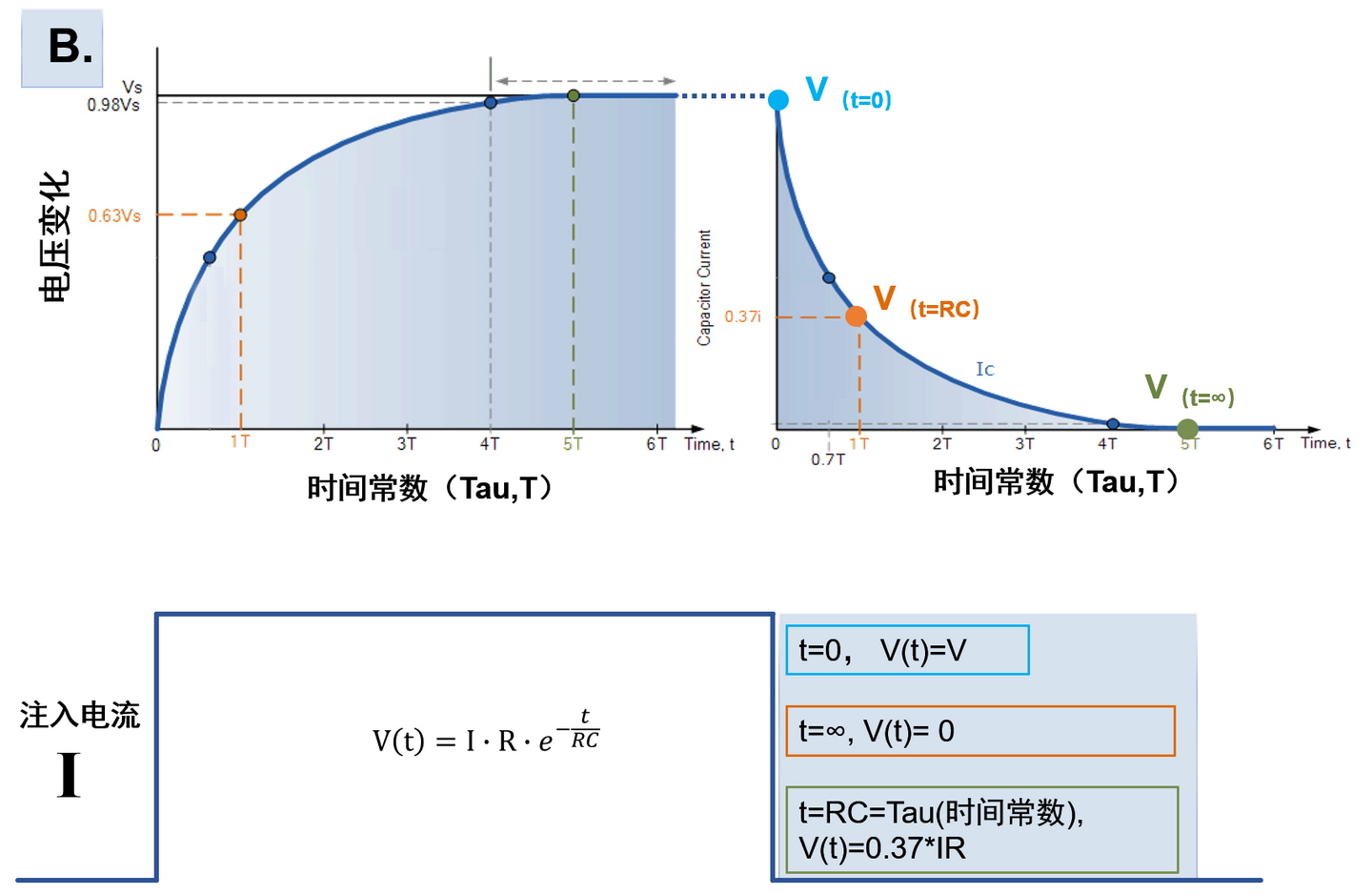
因此对于电流大小与刺激时间也有类似关系:充电时通过电阻的电流大小为
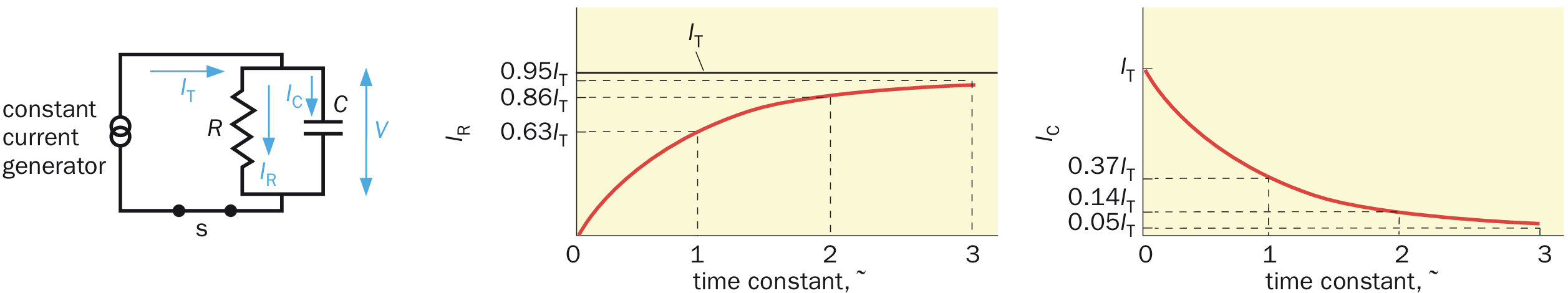
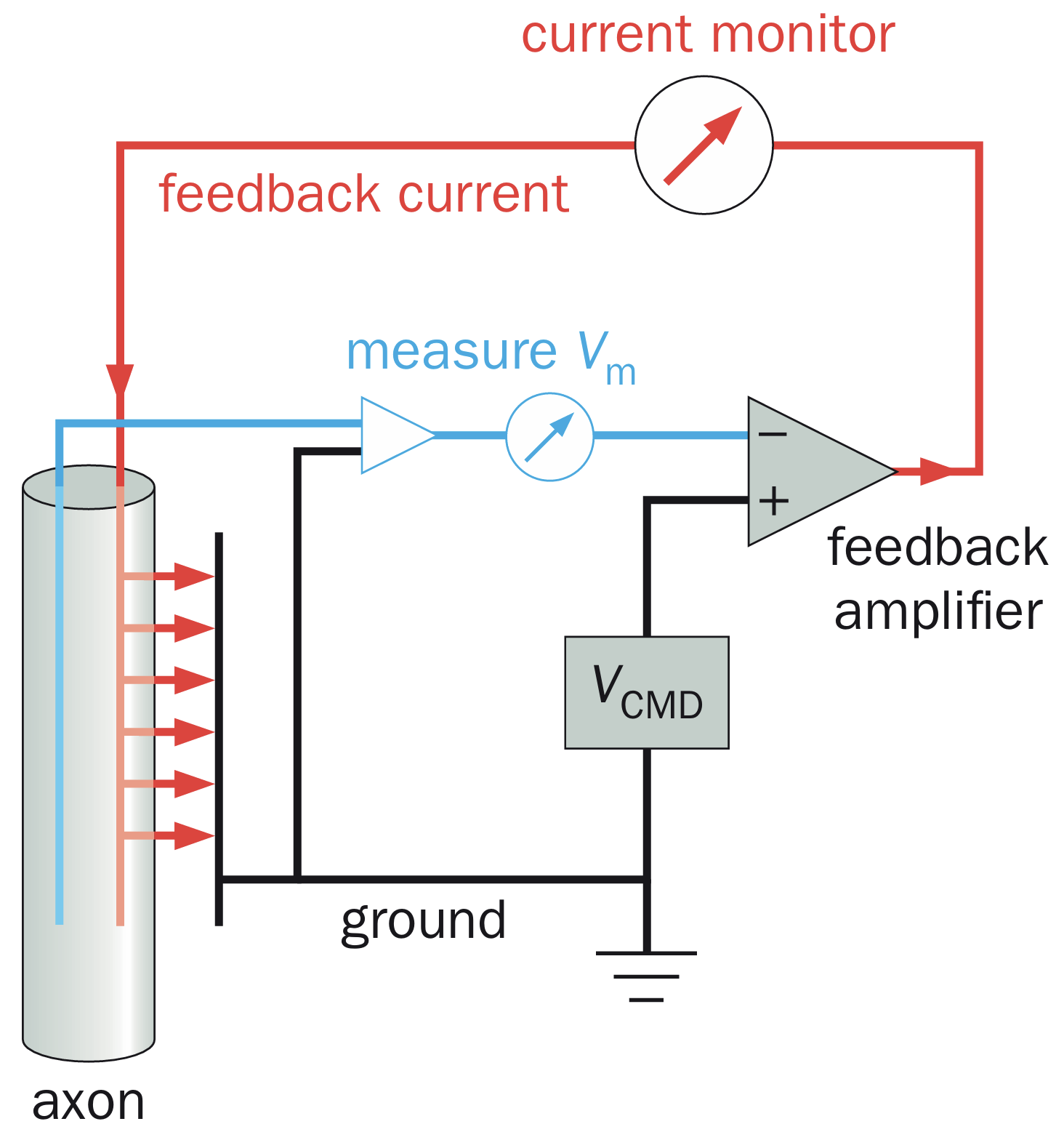
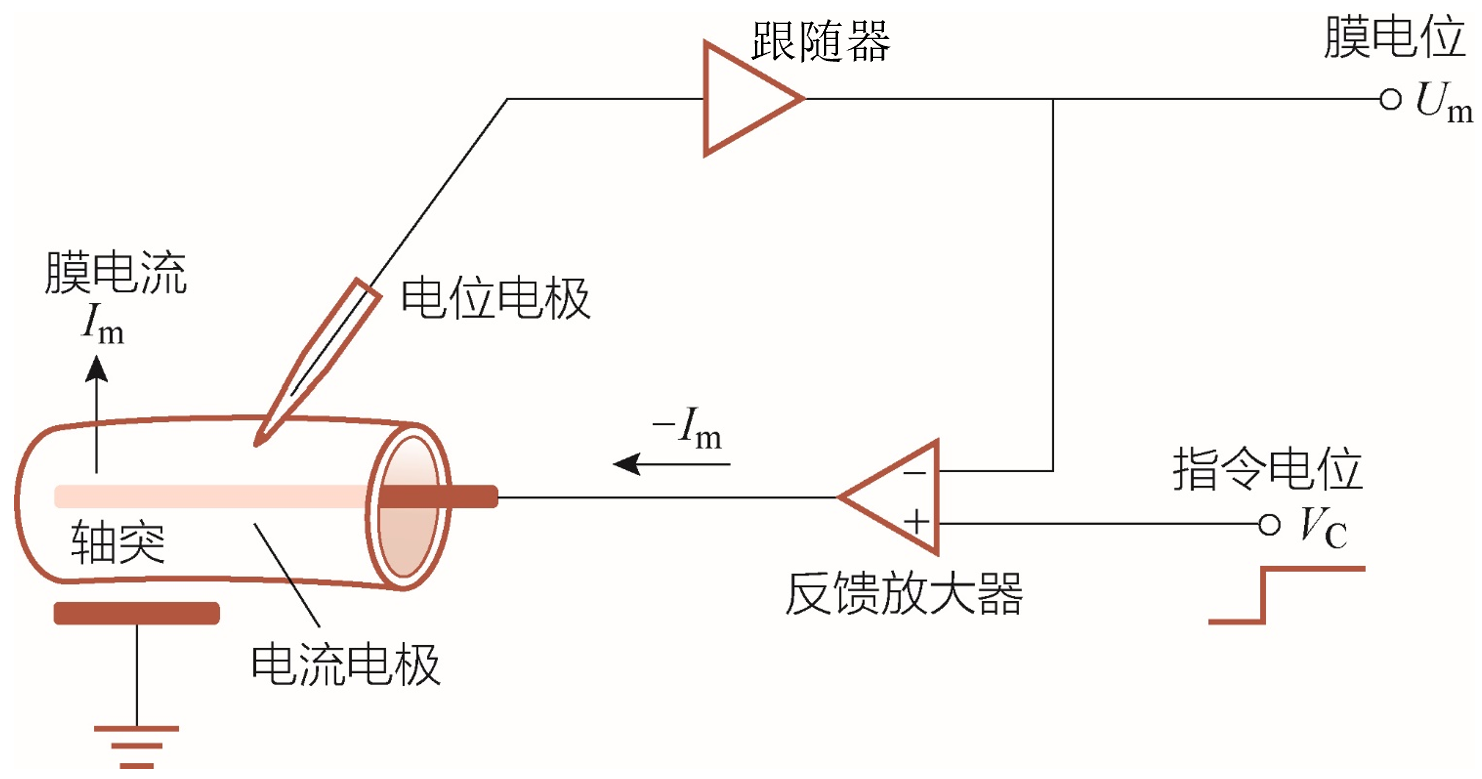
电压钳技术:
正常情况下对细胞膜的刺激会导致膜电位与离子流的共同变化,但这让对于离子流激活的具体情况模糊起来,因此,为了精确分析离子电导的变化与膜电位的关系,需要一种能随心控制膜电位大小的技术。在监控膜电位的同时,也间接测量了对应稳定的膜电位大小状态下的膜电流。下面给出了电压钳的作用原理。
电压钳原理图简要解释
膜电位(
)是通过插入乌贼巨大轴突的蓝色导线并相对于轴突外的接地导线来测量的,然后将其与实验者设置的命令电压( )进行比较,作为电压钳制反馈放大器(大三角形)的两个不同输入。两个电压之间的差值( )产生反馈电流,作为放大器的输出,由第二根插入的导线(红色)注入轴突。当 时就没有反馈电流。在输入发生阶跃变化时,反馈电流在微秒尺度中迅速将 改变为新的 。因此,电压钳制使实验者能够控制被研究轴突的 ,同时测量保持 达到 值所需的反馈电流量,这种反馈电流量等于流过轴突膜的电流(平行的红色箭头)。反馈电流可以向任一方向流动(即红色箭头可以反转),这取决于 和 的相对值。
钠通道激活快、阈电位有差异(神经-50mV、心脏-70mV,但一般认为钠通道是激活电位最负的电压门控通道)。失活快(
钾通道激活较快(
基于电压钳实验提出离子通道模型
前面的玻尔兹曼方程只能说是描述了离子通道在稳态下激活/失活状态变化对电压的依赖性,这种门控的电压依赖性由通道分子的热力学性质决定,并没有对离子通道的时间尺度变化进行描述。Hodgkin-Huxley模型提供了对通道动力学的预测途径,表现离子通道随时间的变化。
Hodgkin-Huxley模型提出时尚未有离子通道的模型,但模型提出电流闸门的开关控制由一定数量的“带电颗粒”决定,离子电流的逐渐增加与“门控颗粒”响应去极化并在开关之间状态切换的过程有关,可以被看做一种与历史状态无关的随机过程:
其中
结合实验的实际结果,调整“带电颗粒”在最大电导和实际电导中的影响权重,同时也考虑有多种对当前电位状态做出不同的反应的“颗粒”(根本原因是在刺激时间足够长时的反应,比如后面Na离子通道建模中的两种“颗粒”:

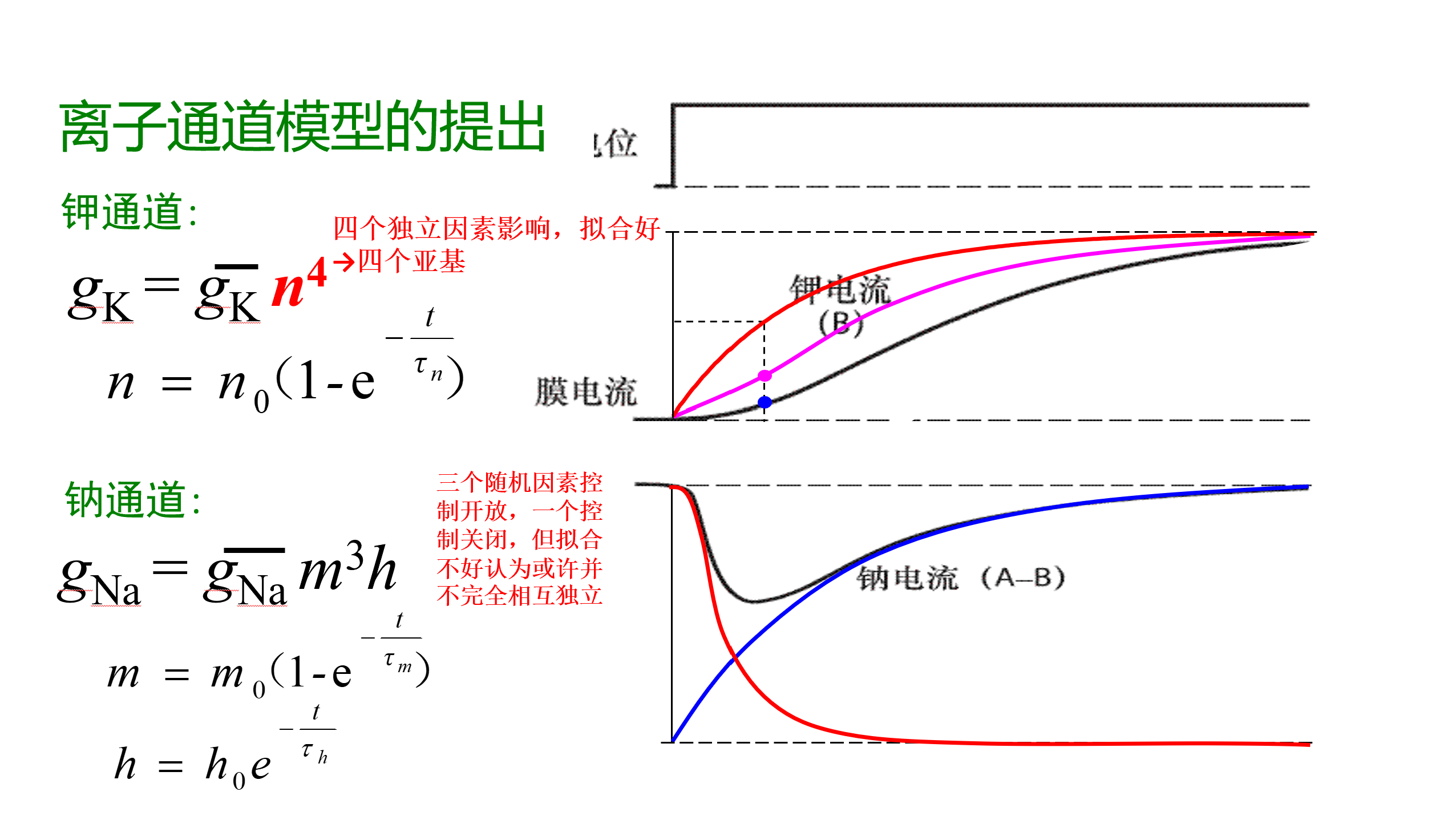
H-H模型中描述的“带电颗粒”事实上真实存在,对应于钾通道的四个亚基和钠通道的四个结构域(“容易理解钠通道不是相同的四个亚基而是连在一起的四个结构域”,书上这么说是因为
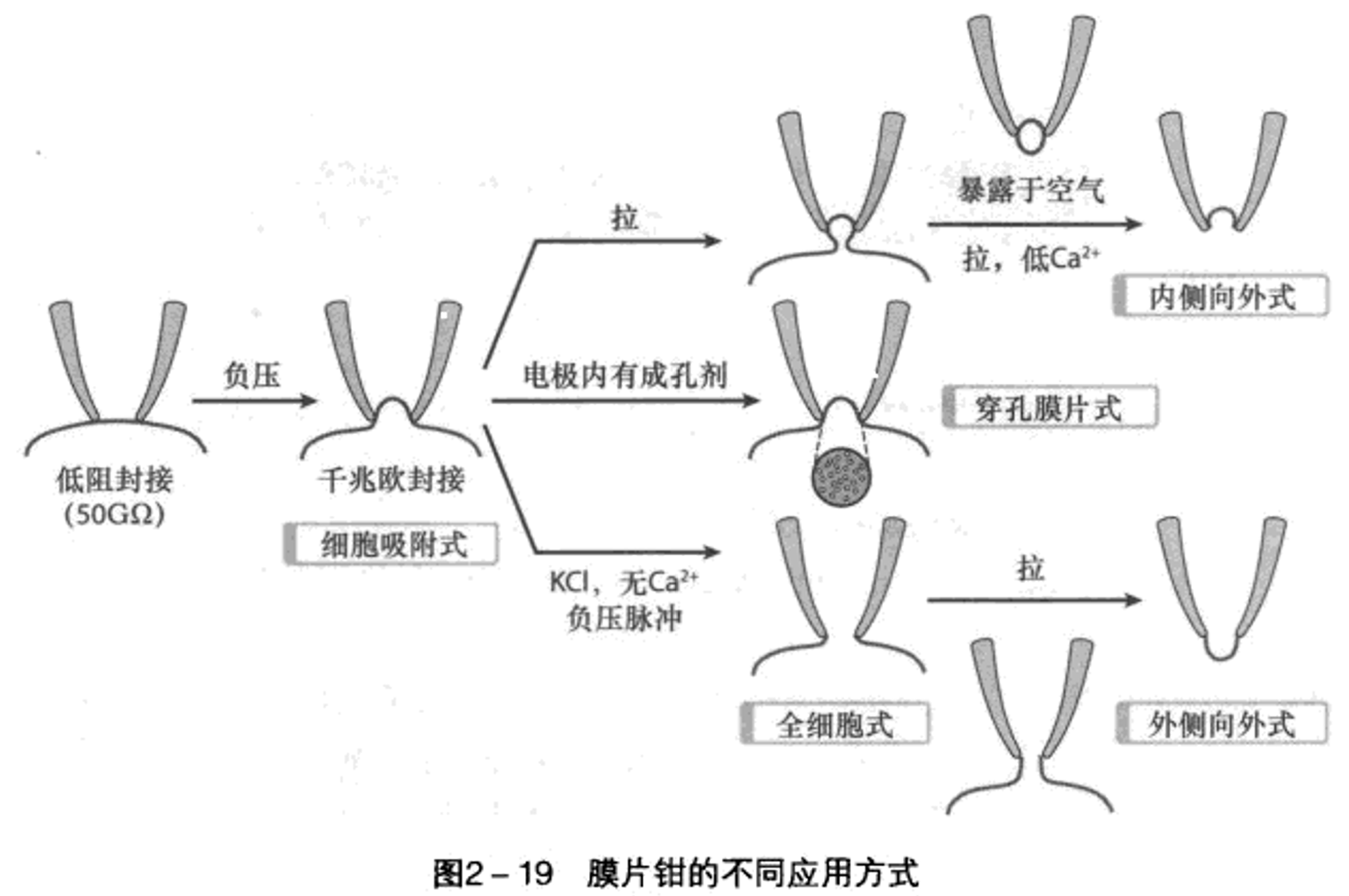
膜片钳技术:
受限于精度,电压钳只能够观察整细胞所有通道对特定电位的群体性反应,其研究结果是“离子电导与膜电位的关系”。后来发展出了膜片钳技术,尽管从电学技术本质来说,膜片钳属于一种特殊的电压钳(负反馈电子回路),而最大区别在于膜片钳有“膜片”——玻璃微电极。玻璃微电极将细胞膜吸住,让封接区域内只有一个离子通道,而高电阻的封接将阻止微小电流的分流。膜片钳的负反馈回路设计得更加简洁,仍然是通过反馈注入电流来测定跨膜电子流。
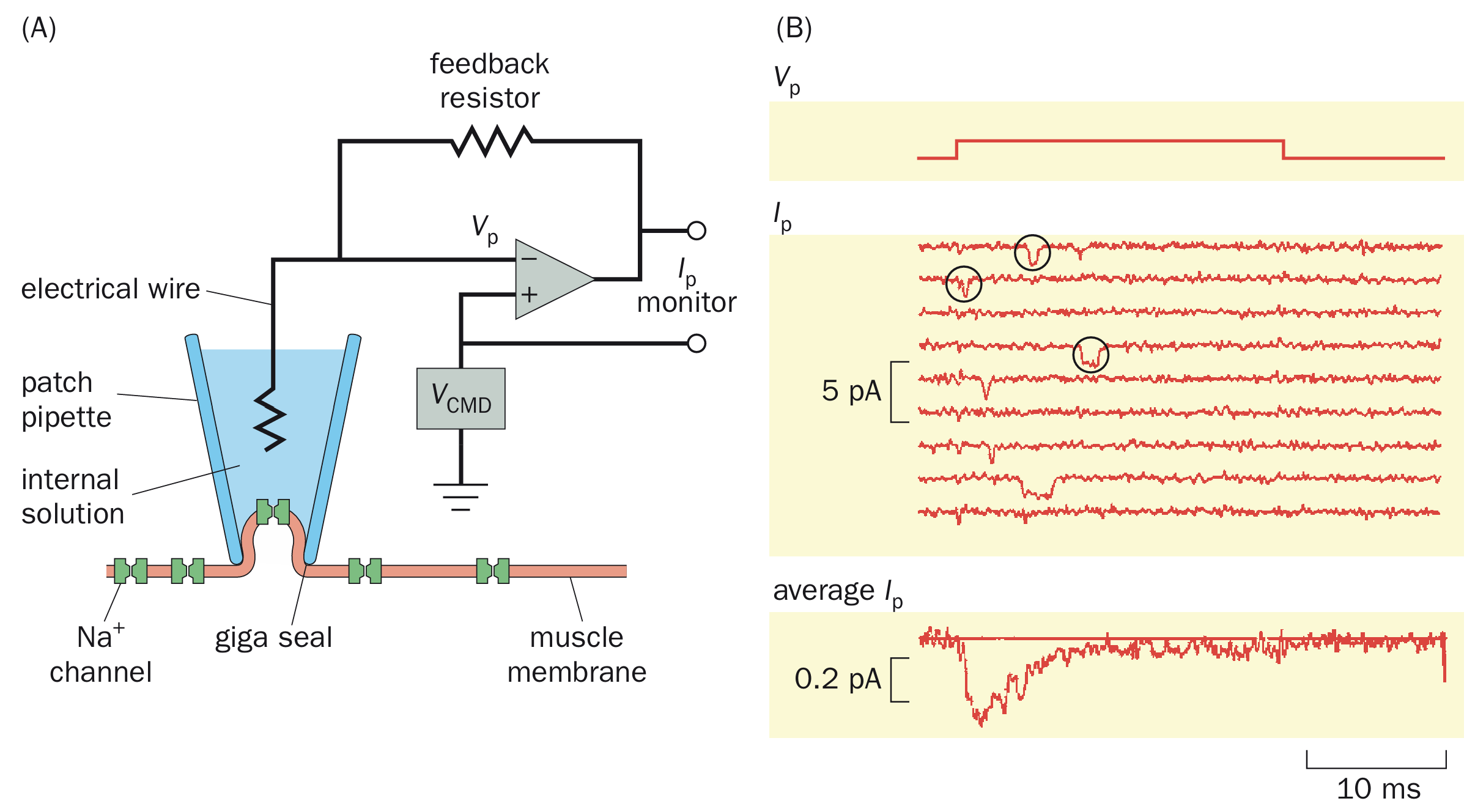
膜片钳技术有多种类型:
细胞吸附式:记录离子通道活动。不方便控制细胞内环境。
内侧向外式:只保留了封接部分,排除细胞内环境因素,同时也由于朝向细胞内的一面暴露,方便研究第二信使、胞质内作用药物。容易更换“细胞内液”环境。
外侧向外式:反着来的,容易控制细胞外液环境。由于涉及一个微电极相接的断裂膜自行融合过程,所以实际实现难度较大。
全细胞式:记录整个整个细胞所有通道产生的总电流,效果与电压钳大差不差了;也可以作电流钳,钳制膜电流以测定静息膜电位。由于保持了细胞完整性,容易通过微电极处向细胞内添加点怪东西,功能较全。但微电极对细胞质的透析作用容易让细胞内小分子流失,造成部分依赖胞内环境的电流随时间而衰减,效果会减弱。因此电极液环境应该接近细胞内环境。电流注入微电极的电阻
应远小于膜电阻 。当给予 刺激后会有电容电流和“漏流电流”(应该说就是过膜的),为了避免激活电压门控通道要用5mV以内超极化或2mV以内去极化刺激。 穿孔膜片式:不击穿,在电极液中添加制霉菌素/两性霉素等可以在膜上打孔的东西,阳离子可以自由通过,又减少大分子的泄露,补偿一部分全细胞式记录的缺点。但由于并不完全击穿,所以输入阻抗大、记录大电流难。
加快动作电位传导的方式:增加膜电阻、减少膜电容充放电、减少轴浆电阻。
1840年Matteucci设计实验,证明生物体的确可以产生电。
刚好能引发动作电位的最小刺激称为“阈刺激”,刺激能否使膜电位达到阈电位并引发动作电位,不仅取决于刺激强度更取决于刺激持续时间。当刺激持续时间足够长的时候,阈刺激将趋于一个最小值(“**基强度,
Lapique强度-持续时间关系经验公式: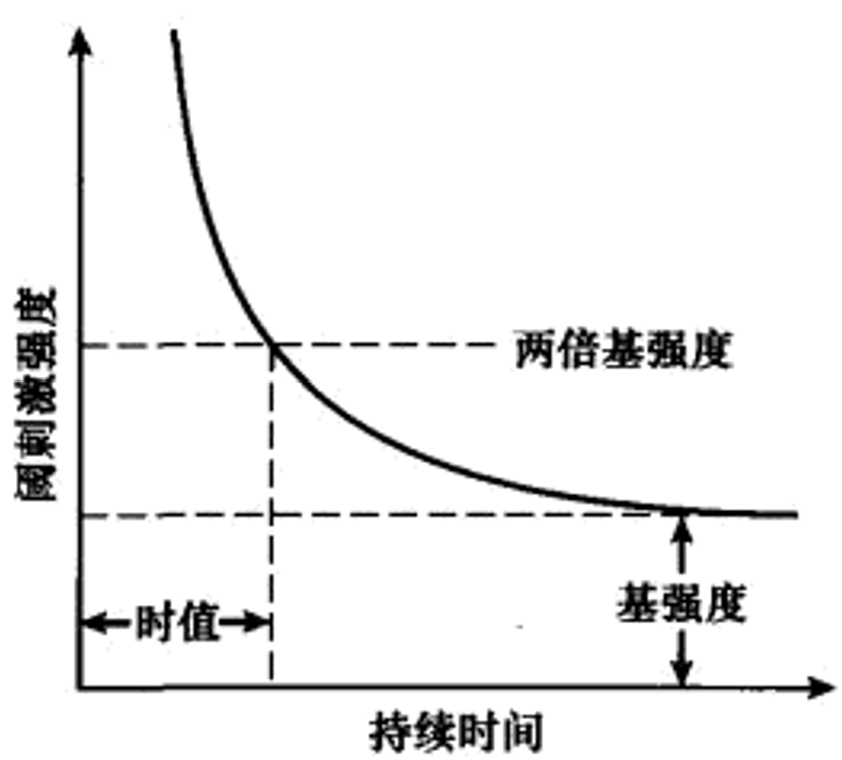
刺激的三要素:刺激强度、刺激持续时间、刺激强度变化率。
兴奋性:可兴奋细胞发生动作电位的难易程度。阈刺激的强度-持续时间Lapique关系曲线体现引发兴奋的难易程度、作为判定可兴奋组织或细胞兴奋性的定量表征(常用“基强度”,或者“时值, chronaxie”,即两倍基强度对应的时间:
1850年Helmholtz用记纹鼓实验测定神经传导速度。
绝对不应期的长短与动作电位时程有关(神经元≤1ms),相对不应期稳定是几毫秒的时长、与动作电位时程相关不大,有效不应期则是对于心肌细胞而言:在绝对不应期及其之后的一段时间内,检验刺激无论是否能够引发被刺激细胞本身的主动反应,都不能引发心肌组织产生可传播的兴奋(可传播性限制主要是相邻细胞通道还死着)。
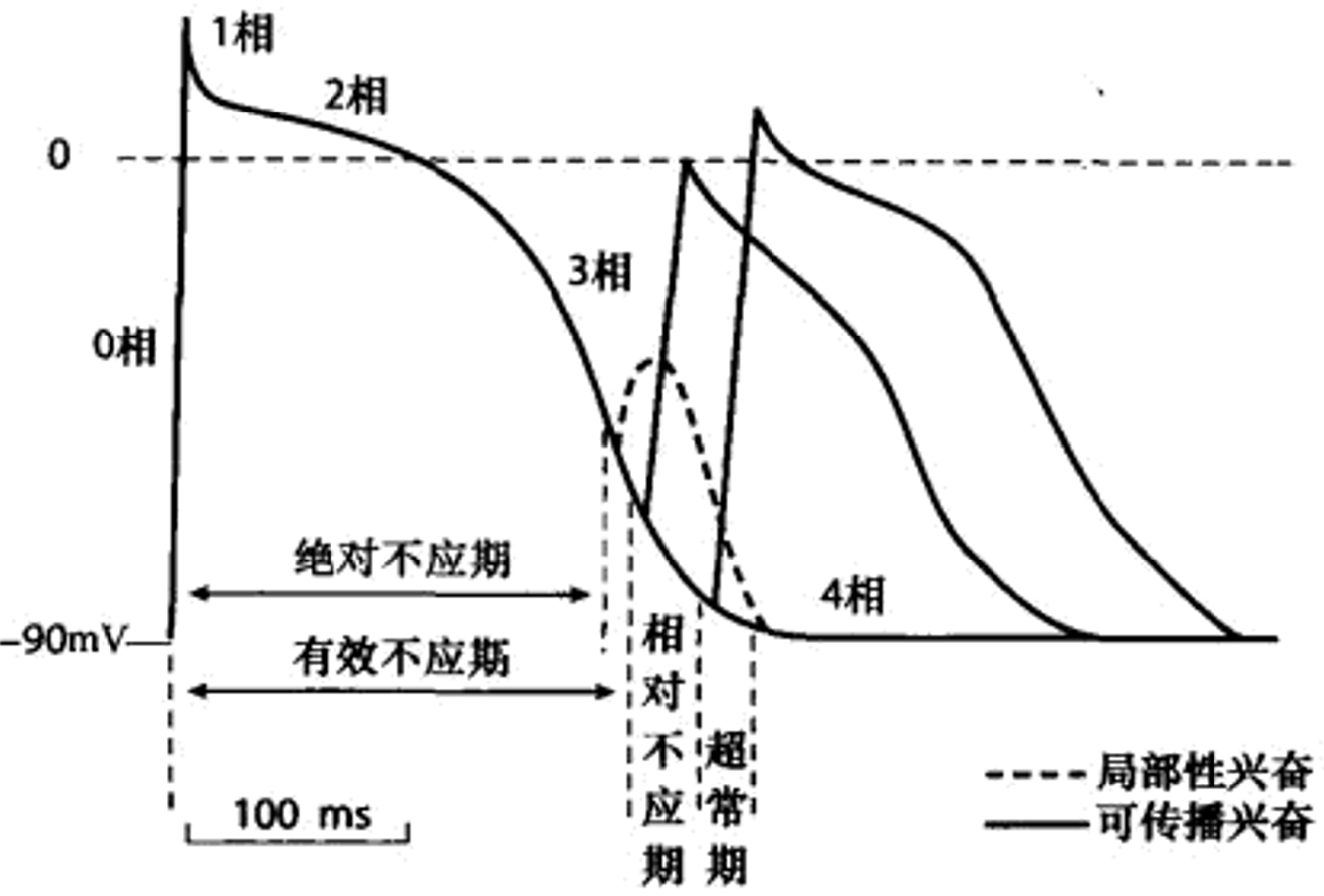
阴极后抑制:长时程阈下去极化电流刺激后细胞兴奋性降低;阳极后增强:长时程超极化电流刺激后细胞兴奋性升高,一定范围内超极化电流越强、兴奋性升高程度越大,极端一点就是阳极断电兴奋,但阳极断电兴奋需要刺激强度比阴极兴奋更大。阴极后抑制与阳极后增强是细胞兴奋性发生适应的产物。
事实上记录动作电位有胞内记录与胞外记录两种,前者涉及微电极技术。
兴奋的传导:
神经纤维的电缆性:轴突这种长的神经纤维,在传递电信号的时候需要考虑到其膜电容、膜电阻、轴向电阻——对应构建模型时的单位长度膜电容(
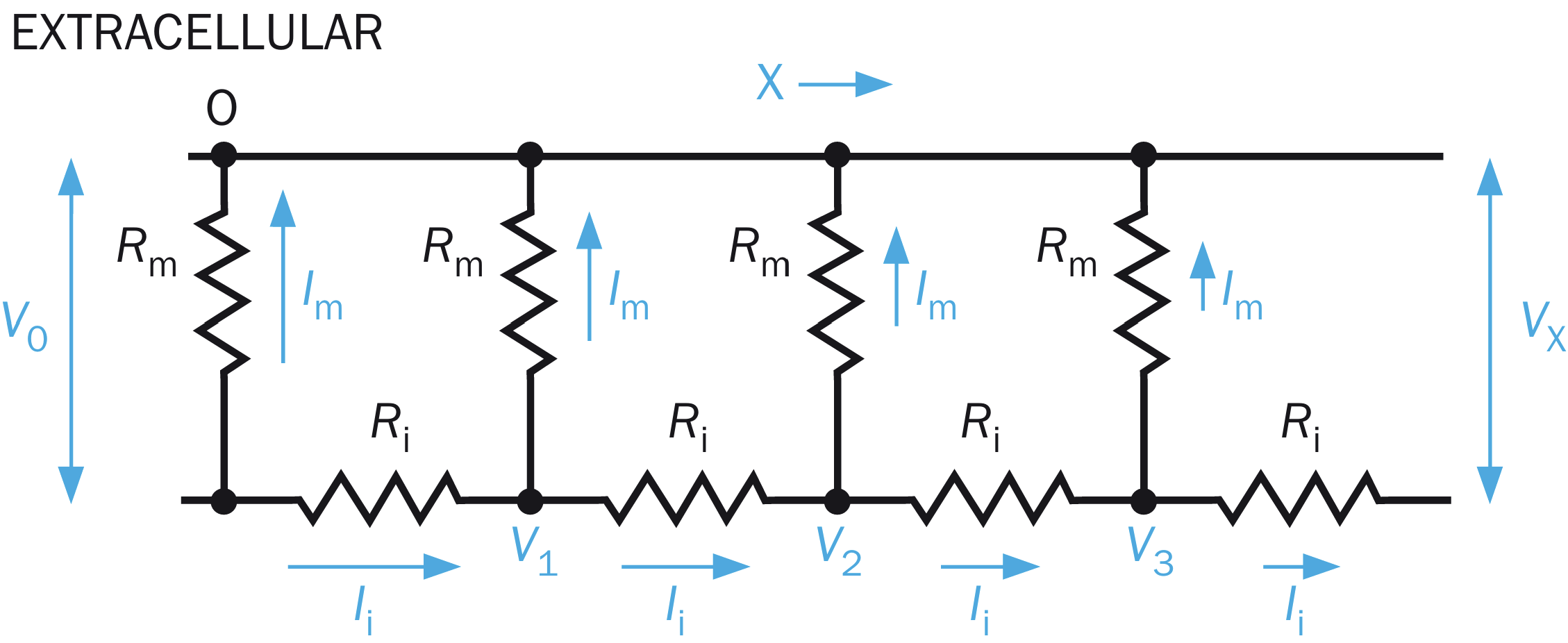
对于具有兴奋的某一点来说,其电位与轴向电流:
解微分方程就能得到(
电紧张电位空间形式的推导
强烈建议搭配上面的简化电路模型食用。
在轴向上,电流与电位梯度成正比,这里的
而在跨膜界面的膜电流则如下,其中
而实际上膜电流来自轴向电流的分流:
以
考虑线性齐次方程的解是
如果有两个实根,则通解为两个指数解的线性组合。然后结合两个边界条件确定系数:
因此
进一步地可以结合轴突的其他电学参数来表示,主要在
神经纤维被动电学性质的综合考虑
细胞内液中轴向上有电压衰减。在把胞外电位定义为0时,
轴向电流衰减到跨膜电流,跨膜电流有电容器充电电流(其实就是经过跨膜电阻的部分)和漏电电流两部分组成:
对于
通通联立,
列出初始条件和边界条件求解偏微分方程在数学上是可行的,但过程较为繁琐且不具有生理学意义。我们考察膜电位为何会随时间和空间发生变化,继而分别求出膜电位对时间和空间的函数,这对我们从本质上理解膜电位随时空的变化过程是有意义的,在操作上也起到了避开偏微分方程、求解常微分方程的简化作用。
实际上在固定空间坐标的时候,也需要考虑轴向电阻的影响(
前置条件是
结合充电状态下的边界条件
稳态下电紧张电位的空间分布推导基本一致,在此不再补充。
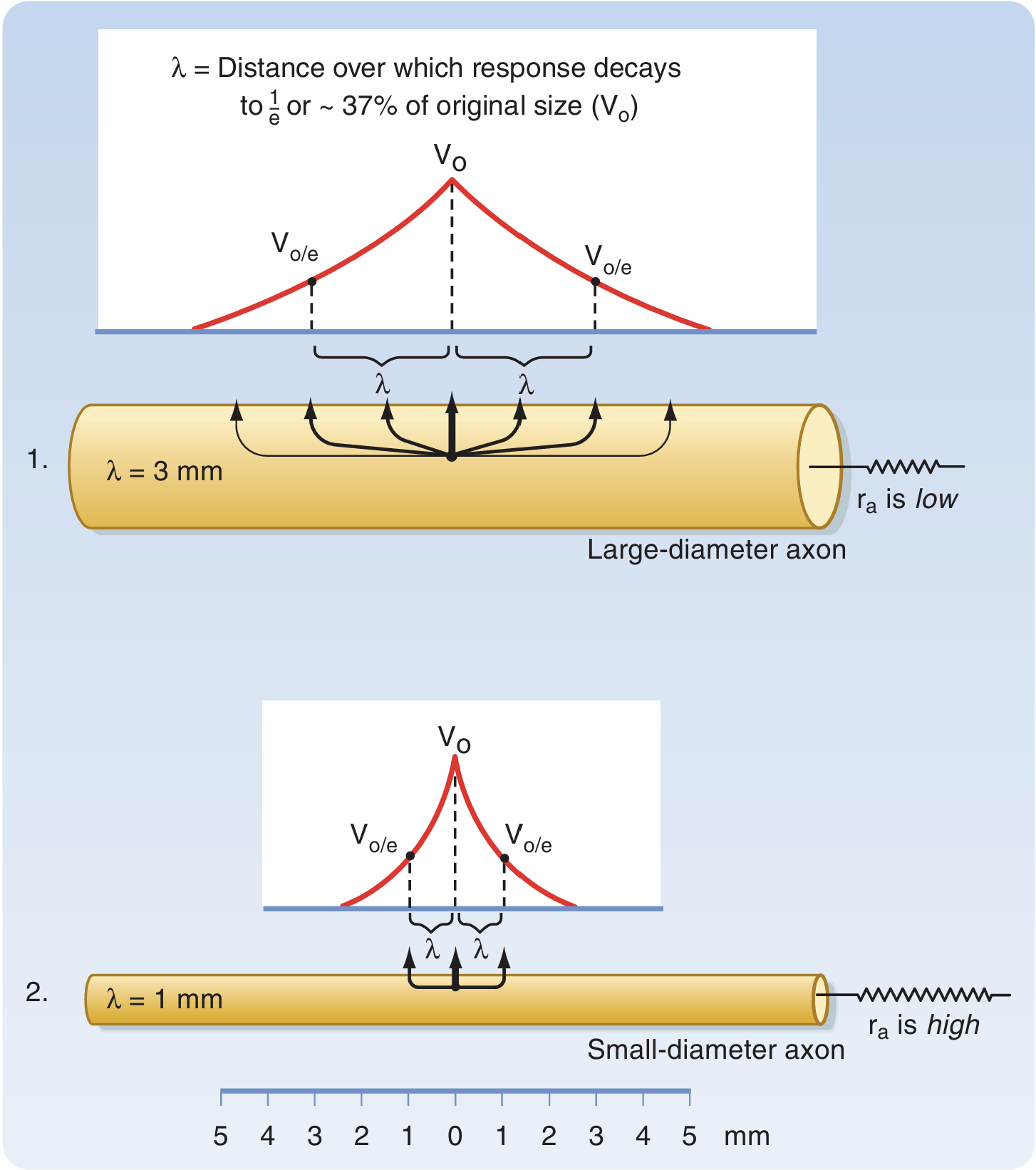
神经信号传播过程中空间编码与频率编码,空间编码以空间换时间,并行性的兴奋代表了更加紧急的信号。
在
而一般考虑神经细胞去极化速率一般相同,则对于不同长度常数
外周髓鞘施旺细胞(Schwann)、中枢少突胶质细胞。包围的细胞膜可达数百层,有效增加膜电阻、增加长度常数;与此同时髓鞘的存在降低膜电容,使膜时间常数减小——去极化和复极化都加快。
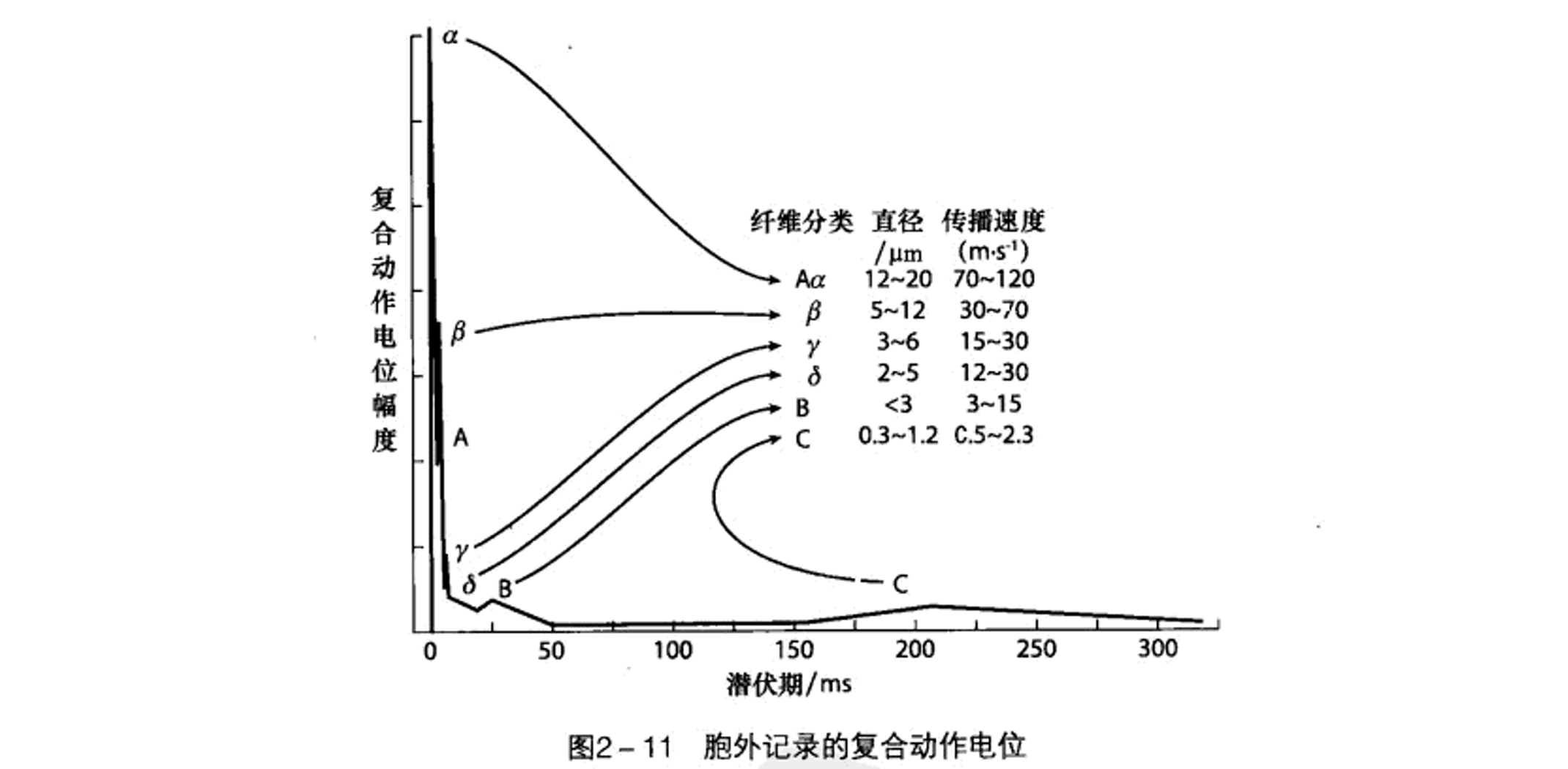
人体中的神经纤维被依据传导速度和功能被分为:外周神经中有髓鞘的A类纤维(
RyR1是骨骼肌型/脑型(海马和小脑中也有)、RyR2是心肌型,RyR3是在全身广泛分布的平滑肌型。骨骼肌那个又叫DHPR(二氢吡啶受体),二氢吡啶作为一类抗高血压药(xx地平),减少血管平滑肌的收缩。
中央核肌病:骨骼肌中细胞核位置异常,原本应该被肌纤维排挤到外周贴近细胞膜的位置。而心肌细胞核在正常情况下应该是细胞中央的。
三联体=侧囊+T横管+侧囊。
细肌丝:肌钙蛋白(三个parts)、原肌球蛋白、肌动蛋白。
L型钙通道受二价阳离子
行吧行吧,虽然在心肌但是这里打表罢:
| 类型 | 特点 | 功能 |
|---|---|---|
| L型钙通道( |
激活电位-30mV,激活速度20ms,失活速度500ms | 神经元胞体、心肌、骨骼肌。肌细胞兴奋偶联关键 |
| T型钙通道( |
激活电位-50mV,激活速度2ms,失活速度20~30ms | 多种组织中都存在 |
| N型钙通道( |
激活电位-40mV,激活速度5~10ms,失活速度50~80ms | 主要在神经组织突触处,递质释放 |
| 瞬时外向钾通道( |
激活2ms,失活20ms。4-AP(4-氨基吡啶)阻断 | 神经细胞电位复极化 |
| 延迟整流钾通道( |
有快慢激活等亚型。缓慢激活和失活(200~1000ms)。整流向外。TEA(四乙铵)阻断 | 心肌电位复极化 |
| 内向整流钾通道( |
有很多种类型,都不是电压门控通道,整流性强 | 内向整流不等于内向电流 |
| 超极化激活的环式核苷酸门控阳离子通道(HCN channel。神经中是 |
超极化激活,对钾钠离子没有明显选择性,但激活后肯定是 |
交感神经控制心率就是靠其cAMP门控 |
氯离子通道与钾离子通道类似,逆转电位低于静息电位,但氯离子通道一般都仅作背景电流,只在部分细胞中辅助复极化。
心肌电流:
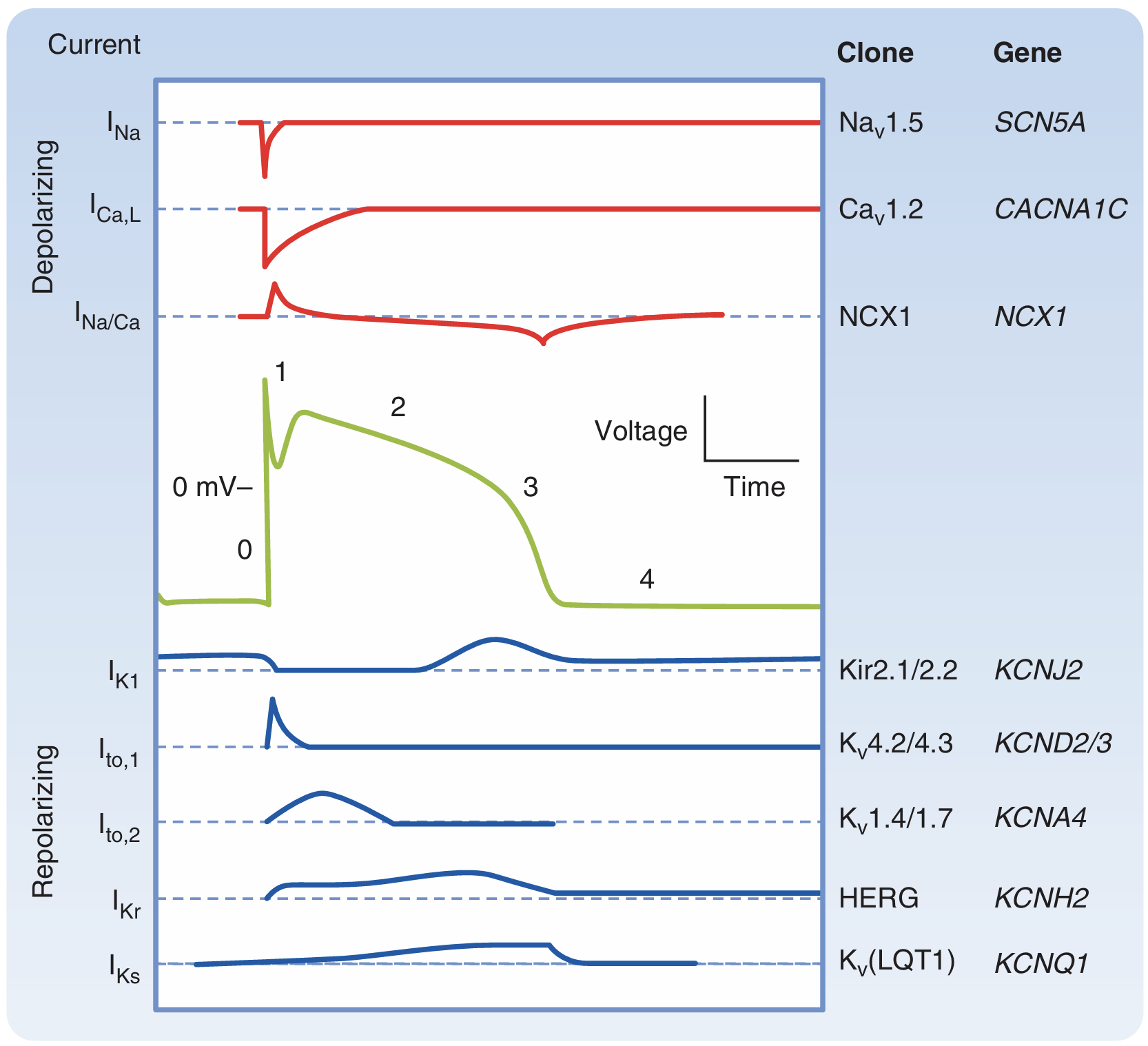
起搏细胞基本不表达钠通道,一般有
电突触:广泛存在于神经细胞间、胶质细胞间、心肌细胞间、平滑肌细胞间等。现在gap junction也有发现8、10、12、13等聚合的。相对分子量1k以下的都能过间隙连接,cAMP、IP
啥的都能过,具有代谢耦联作用,在细胞分化方面也有影响。少数无脊椎动物的电突触具有整流功能,只能单向通电。
非定向神经突触见于自主神经对心肌、平滑肌的控制,CNS中释放多巴胺、5-HT等单胺类递质的神经纤维也有。
- Title: Physiology
- Author: Kirschy
- Created at : 02-18-2025 00:00:00
- Updated at : 04-23-2025 19:51:04
- Link: https://kirschyr.github.io/2025/02/18/Physiology/
- License: This work is licensed under CC BY-NC-SA 4.0.
